На имплантах и протезах часто возникают бактериальные инфекции, и поэтому ученые ищут разные способы придать их поверхности антибактериальные свойства. Исследователи из Российского химико-технологического университета им. Д. И. Менделеева, Национального медицинского исследовательского центра травматологии и ортопедии им. Н. Н. Приорова и Университета Крита разработали новый материал для протезов — полимерный биокомпозит, который содержит мощный антибиотик амикацин. Антибиотик выходит из материала только при бактериальной атаке, а интенсивностью его выделения можно управлять, изменяя толщину композита. О результатах исследования, опубликованных в журнале Polymer International, сообщил отдел научных коммуникаций РХТУ им. Д. И. Менделеева.
На поверхности имплантов могут поселиться бактерии, например, у 2–3 % пациентов с протезами сердечных клапанов развивается бактериальное воспаление, называемое эндокартитом. Есть разные способы остановить инфекцию: прием антибиотиков, хирургическое вмешательство, модификация поверхности протезов частицами серебра с выраженным антибактериальным эффектом. Один из самых перспективных — создание протезного материала с иммобилизованным, то есть встроенным на его поверхность антибиотиком. В идеальном случае антибиотик должен выходить из материала только в присутствии инфекции, так он с одной стороны не закончится слишком быстро, а с другой — не спровоцирует побочные токсические эффекты.
«Мы иммобилизовали антибиотик широкого спектра действия амикацин на полисахариде под названием декстран, а потом на основе этого материала сделали биокомпозит, — рассказывает первый автор работы, профессор РХТУ Валерий Дятлов. — У человека нет декстраназы — фермента, разлагающего декстран, но зато его производят бактерии. Поэтому, как только они атакуют биокомпозит, их ферменты начинают его разлагать, и из композита выходят химические соединения амикацина, которые тоже, как и чистый амикацин, обладают выраженным антибактериальным действием. Так мы разработали материал, который способен в ответ на бактериальную атаку точечно высвобождать антибиотик».
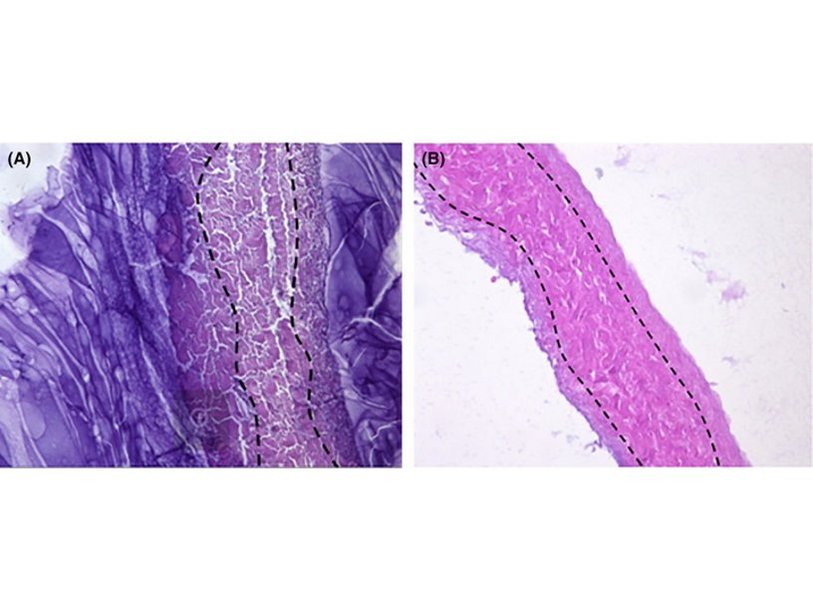
Для создания биокомпозитов ученые использовали два ксеноматериала — так называют клеточные матрицы, полученные после химической обработки живых тканей. В этой работе применяли ксеноматериалы на основе перикарда (ткань наружной оболочки сердца) и глиссоновой капсулы (ткань оболочки печени), которые уже давно используют в медицине для создания протезов.
«Мы синтезировали биокомпозит в несколько этапов, — говорит один из авторов работы, сотрудница РХТУ Анна Лусс. — Сначала декстран обрабатывали эпихлоргидрином, и так на нем появлялись эпоксидные группы — за счет них декстран связывался с амикацином и получался гель. Потом гель наносили на ксеноматериалы, и он химически сшивался с ними, пропитывая ксеноматериалы на определенную глубину. Толщина полученного биокомпозита из перикарда составляла 0,42 мм, а из глиссоновой капсулы — 0,15 мм, в то время как глубина проникновения декстрана в них равнялась 0,10 и 0,03 мм, соответственно».
В модельных экспериментах с чистой декстраназой ученые показали, что из биокомпозита на основе глиссоновой капсулы весь амикацин выделяется за 2 часа, а из композита на основе перикарда — за 24 часа. Антибактериальная активность новых материалов была проверена на бактериях S. aureus, B. subtilis и S. pyogenes. Композиты приводили в контакт с бактериальными культурами, выращенными в чашке Петри, и по истечении 24 часов наблюдали подавление роста бактерий в зоне вокруг ксеноматериалов, а также под ними и на их поверхности. Кроме того, биокомпозиты вводили под кожу лабораторным кроликам: там не было бактериальных возбудителей, и даже через 12 суток весь амикацин оставался внутри ксеноматериала.
Исследователи выяснили, какие факторы определяют скорость выделения антибиотика. «Оказалось, что быстрота ответа на бактериальную атаку определяется скоростью диффузии продуктов гидролиза модифицированного амикацином декстрана — то есть прошла реакция где-то в глубине ксеноматериала, выделились гликозиды амикацина, а дальше они должны дойти до поверхности, и скорость этого процесса определяет общую скорость выделения антибиотика, — рассказывает заведующий кафедрой биоматериалов РХТУ и один из авторов работы, профессор Михаил Штильман. — Если эта стадия лимитирующая, то получается, что скорость выделения антибиотика определяется толщиной слоя геля, пропитавшего ксеноматериал. Если хочется, чтобы вещество выделялось медленно и имплант выдержал много бактериальных атак, то делаешь биокомпозит толще. А если врачи уверены, что рассчитывать на серию атак не надо, тогда делаешь композит тоньше, из которого выделение антибиотика будет более резкое и с большой скоростью».